Sifat induksi terjadi karena adanya perbedaan keelektronegatifan. Gejala
elektrostatik diteruskan melalui rantai karbon. Efek induksi
terdiri atas dua yaitu +I (pendorong electron) dan –I (penarik
electron). Menurut konvensi gugus penarik electron yang lebih
besar dari hydrogen H merupakan efek induksi –I sedangkan gugus penarik
electron yang lebih lemah dari hydrogen H merupakan efek induksi +I. Gugus
alkyl yang terikat pada gugus fungsi senyawa organic merupakan gugus
pendorong electron, dimana semakin besar alkyl yang terikat pada gugus fungsi
akan mengakibatkan factor +I semakin besar.
Berikut ini urutan reaktifitas induksi –I (penarik electron) adalah
sebagai berikut:
-Cl > -Br > -I > -OCH3 > -OH > -C6H5
> -CH+CH2 > -H
Efek induksi dari beberapa gugus yang terikat pada gugus fungsi
senyawa organic dapat dilihat pada tabel berikut ini,
Tabel 1. Efek
induksi beberapa gugus
-I
|
+I
|
||
-NH3+
|
-OR
|
-CH3
|
|
-NR3+
|
-SH
|
-CH2R
|
|
-NO2
|
-F
|
-SR
|
-CHR2
|
-Cl
|
-CH=CH2
|
-CR3
|
|
-COOH
|
-Br
|
-CR=CH2
|
|
-COOR
|
-OH
|
||
Untuk mempelajari atau menentukan efek induksi suatu
gugus/atom yang terikat pada senyawa karbon dilakukan pengkajian terhadap keasaman
senyawa asam karboksilat baik berupa senyawa alifatik maupun senyawa aromatik.
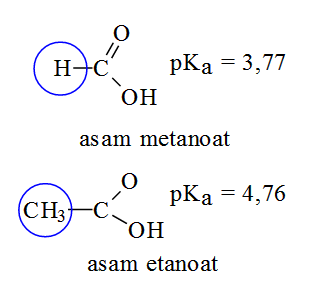
Perhatikan harga pKa dua asam karboksilat berikut.
Kekuatan asam metanoat berbeda dengan kekuatan asam
etanoat, asam metanoat lebih kuat. Jika dilihat dari struktur kedua asam di
atas, dapat diperkirakan perbedaan kekuatan asam tersebut disebabkan oleh pengaruh
gugus –CH3. Dibandingkan asam metanoat, kekuatan asam etanoat lebih lemah. Gugus
–CH3 pada asam etanoat mempunyai kemampuan mendorong elektron ikatan melalui
ikatan sigma (C-C-O-H) sehingga atom O menjadi relatif negatif, akibatnya atom
H sukar lepas sebagai H+, asamnya menjadi lebih lemah. Gugus –CH3 dikatakan mempunyai
efek induksi mendorong elektron dan diberi simbol +I. Untuk efek induksi gugus/atom
lain dapat dipelajari dari harga pKa berikut.
Bagaimana kekuatan asam (2) dan (3) dibandingkan asam
(1)? Asam (2) dan (3) lebih kuat dibandingkan asam (1), mengapa? Dilihat dari
struktur ketiga asam di atas, tentunya perbedaan kekuatan asam tersebut dikarenakan
adanya substituen –Cl dan –OH pada asam (2) dan asam (3).
Substituen –Cl dan –OH
mempunyai kemampuan menarik elektron ikatan melalui ikatan sigma (C-C-O-H)
sehingga atom O menjadi relatif positif, akibatnya atom H mudah dilepas sebagai
H+ dan asamnya menjadi lebih kuat. Gugus –OH dan –Cl dikatakan mempunyai efek induksi
menarik elektron dan diberi simbol –I.
Efek induksi tidak hanya berpengaruh
terhadap keasaman tetapi juga terhadap kebasaan dan kereaktifan senyawa karbon.
Kebasaan amoniak dan metil amonia dapat berbeda karena adanya efek induksi dari
gugus –CH3.
Kekuatan basa dapat ditinjau dari kemampuan molekul/senyawa
untuk mendonorkan pasangan elektron bebasnya. Dilihat dari kekuatan basanya, metil
amina lebih kuat (pKb-nya lebih kecil). Mengapa demikian? Tentunya karena pada
metil amina terdapat gugus –CH3. Gugus –CH3 mempunyai efek induksi mendorong
elektron sehingga pasangan elektron bebas pada atom N lebih mudah didonorkan.
Akibatnya kebasaan metil amina lebih kuat dibandingkan amonia.
Efek induksi terjadi
karena adanya pergeseran elektron ikatan dalam molekul senyawa sehingga terjadi polarisasi
ikatan dalam molekul tersebut.
Klor (Cl) lebih elektronegatif daripada C, maka elektron ikatan lebih tertarik ke Cl, sehingga terjadi polarisasi ikatan. Atom Cl menjadi relatif lebih negatif (d-) sedangkan atom C menjadi relatif positif (d+). Suatu gugus/atom dikatakan mempunyai efek induksi positif (+I) bila mempunyai kemampuan menolak elektron lebih kuat dari pada atom hidrogen dalam molekul yang sama. Sedangkan gugus/atom yang mempunyai kemampuan efek induksi negatif (-I) adalah gugus/atom yang lebih kuat menarik elektron dari pada atom H.
Dari uraian di atas dapat dibuat pengertian efek
induksi. Efek induksi dapat diartikan sebagai kemampuan suatu gugus/atom yang terikat dalam suatu molekul untuk
menolak atau menarik elektron,dibandingkan dengan atom hidrogen dalam molekul
yang sama sehingga terjadi polarisasi ikatan. Efek induksi bekerja melalui
ruang dan ikatan sigma (s) atau ikatan tunggal. Makin jauh letak gugus/atom yang
memiliki efek induksi, makin kecil pengaruhnya terhadap polarisasi ikatan.
Sumber :